题型:综合题 题类:真题 难易度:普通
2017年高考化学真题试卷(海南卷)
下列叙述正确的有( )
ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
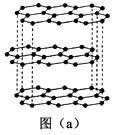
1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为,原子间存在的共价键类型有,碳原子的杂化轨道类型为。
2)SiCl4分子的中心原子的价层电子对数为,分子的立体构型为,属于分子(填“极性”或“非极性”)。
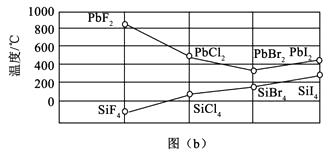
3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性、共价性。(填“增强”“不变”或“减弱”)
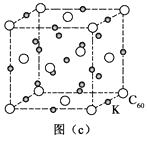
4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为;其晶胞参数为1.4 nm,晶体密度为
g·cm-3。
试题篮