题型:实验探究题 题类:模拟题 难易度:普通
2017年广东省茂名市高考化学一模试卷

实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3﹣能将H2SO3氧化为SO42﹣ |
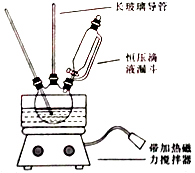
①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
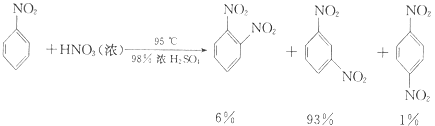
(i) ![]() +HNO3(浓)
+HNO3(浓)
![]() +H2O
+H2O
(ii)可能用到的有关数据列表如下
|
物质 |
熔点/℃ |
沸点/℃ |
密度(20℃)/g•cm﹣3 |
溶解性 |
|
苯 |
5.5 |
80 |
0.88 |
微溶于水 |
|
硝基苯 |
5.7 |
210.9 |
1.205 |
难溶于水 |
|
1,3﹣二硝基苯 |
89 |
301 |
1.57 |
微溶于水 |
|
浓硝酸 |
|
83 |
1.4 |
易溶于水 |
|
浓硫酸 |
|
338 |
1.84 |
易溶于水 |
请回答下列问题:

已知:ⅰ.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
iⅱ.部分物质的溶度积常数如下(25℃)
|
物质 |
Ksp |
|
CaF2 |
|
|
Fe(OH)3 |
|
ⅲ.CoSO4∙7H2O溶解度随温度升高而明显增大
试题篮