题型:综合题 题类:常考题 难易度:普通
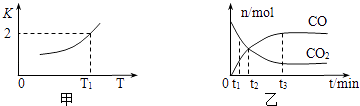
①该反应的逆反应是(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2 , 反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为,平衡时混合气体的密度与起始时气体的密度之比为.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
起始时乙容器中的压强是甲容器的倍.
试题篮