题型:综合题 题类:常考题 难易度:普通
吉林省白城市第十四中学2019-2020学年高三上学期化学期中考试试卷
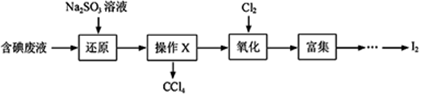
①取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②;
③另从水层中取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化后,滴加Na2SO3溶液,若溶液变蓝说明废水中含有IO3-;否则说明废水中不含有IO3-。
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
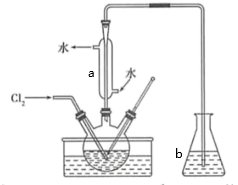
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L﹣1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
试题篮