修改时间:2021-10-18 浏览次数:185 类型:单元试卷
①取少量固体于试管中,加适量蒸馏水,固体完全溶解得透明溶液;
②在①所得溶液中,滴加足量BaCl2溶液,产生白色沉淀。过滤后,在白色沉淀中加过量稀盐酸,沉淀部分溶解,且有气泡产生。
下列对原固体成分 ![]() 说法正确的是( )
说法正确的是( )
①取该样品溶于水,得到无色溶液;
②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;
③向步骤②所得沉淀中加入过量的稀HNO3 , 沉淀全部消失并产生气泡。
下列分析中正确的是( )
⑴取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液。
⑵取上述无色溶液少许于试管中,滴加AgNO3溶液有沉淀生成,再加入足量的稀HNO3溶液,沉淀部分溶解。
⑶另称取1.38g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的BaCl2溶液,充分反应后生成1.97g白色沉淀。下列说法正确的是( )

查阅资料可知碱石灰是 CaO 和 NaOH 的混合物。回答下列问题:
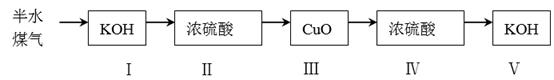
若步骤Ⅳ中浓硫酸质量增加a 克,步骤Ⅴ的KOH溶液质量增加b 克,则半水煤气中H2与CO的质量比为(用含字母a、b的代数式表示)。

Ⅰ.称取7克固体于烧杯中,加入足量水充分溶解,过滤得到白色沉淀4.3克和无色溶液.
Ⅱ.Ⅰ中所得4.3克白色沉淀中加入足量稀盐酸,沉淀部分溶解并有无色气体产生,测得剩余白色沉淀质量为2.33克.
Ⅲ.把Ⅰ中所得滤液分成两份,第一份溶液中加入足量的稀硫酸,既没有产生气泡,也没有产生沉淀,第二溶液中加入足量的氯化钡溶液,没有产生沉淀.
根据上述实验,回答下列问题:

|
序号 |
实验步骤 |
实验现象 |
|
1 |
连接好仪器后,检査气密性:关闭A的活塞,用酒精灯微热硬质玻璃管一 会儿,再撤掉。 |
说明气密性良好 |
|
2 |
在C中加入样品W克,称得D检查气密性后总质量为m1克 |
/ |
|
3 |
打开A的活塞,慢慢滴加溶液。 |
B、E中有气泡产生 |
|
4 |
对C进行加热,当C中药品充分反应后,关闭A的活塞,停止加热。 |
/ |
|
5 |
冷却后,称得D的质量为m2克 |
/ |

|
实验次数 |
1 |
2 |
3 |
4 |
|
加入稀硫酸质量/克 |
20 |
20 |
20 |
20 |
|
剩余固体质量/克 |
20.0 |
17.4 |
14.8 |
13.5 |
请分析计算:
试题篮