修改时间:2021-08-05 浏览次数:149 类型:同步测试

①未经冷却趁热将溶液注入容量瓶中;
②定容时仰视刻度线;
③用量筒量取浓硫酸时俯视;
④移液时不慎将少量溶液滴在容量瓶外面。
①向容量瓶中加入蒸馏水至距刻度线1~2 cm时,应;
②加蒸馏水时不慎超过了刻度,应。
|
容量:500mL分析纯 品名:浓盐酸 化学式:HCl 外观合格符合GB622-89 相对分子质量:36.5 质量分数:0.365 密度:1.18g·cm-3 试剂生产许可证编号:××× 上海××化学试剂厂 |
A.定容时仰视刻度线;
B.容量瓶内壁附有水珠而未干燥处理;
C.溶解后没有冷却便进行定容。

图中球形干燥管的作用是。

为测定生成气体的体积,量气装置中的X液体最好选择。
a.CCl4
b.H2O
c.饱和NH4Cl溶液
d.浓硫酸

写出步骤反应的离子方程式。
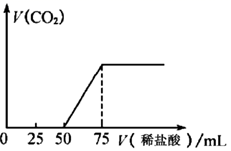
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是(填写化学式)
②滴入 稀盐酸过程中,溶液导电性(填“增强”或“减弱”),试解释其原因。
③原 氢氧化钠溶液的浓度为。
试题篮