修改时间:2024-07-13 浏览次数:110 类型:期末考试
|
a |
|||||||||||||||||
|
b |
c |
||||||||||||||||
|
d |
e |
f |
g |
h |
|||||||||||||
①最高价氧化物对应水化物的酸性h比g的强
②单质与变价金属反应,产物的价态h比g的高
③简单气态氢化物对应水溶液的酸性h比g的强
④h的单质可将g的单质从其化合物中置换出来
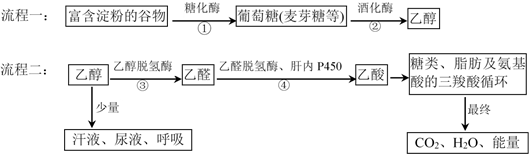
a.由谷物酿造的酒,对人体有益而无害,可放心饮用
b.蛋白质、淀粉水解的最终产物分别是氨基酸和葡萄糖
c.交警用酒精检测仪(含K2Cr2O7)查“酒驾”,其实质是乙醇被氧化
d.脂肪属于高分子化合物,水解后才能被人体吸收
e.啤酒的度数一般是3~5(%vol),表示的是100mL酒中含有3~5g乙醇
 ) 是一种解热、镇痛和消炎药物,可由水杨酸(
) 是一种解热、镇痛和消炎药物,可由水杨酸( ①C4H10(g)=C4H8(g)+H2(g) △H1=+123 kJ•mol-1
②H2(g)+ O2(g)=H2O(g) △H2=-242kJ•mol-1
则丁烷与氧气反应生成丁烯和水(g)的热化学方程式为。

①105Pa时,图1中表示丁烯的曲线是(填字母序号)。
②若在105Pa、500 ℃条件下,该反应经过10 min达到平衡状态,则0~10 min内氢气的生成速率v(H2)=mol•L-1•min-1。此时,丁烷的平衡转化率为。
③在104Pa、500 ℃条件下,该反应的化学平衡常数K=。
④在一定条件下实际测得丁烯产率与温度关系如图所示。由图可知,温度高于590 ℃时,随着温度升高,丁烯产率降低,可能的原因是。

试题篮