修改时间:2021-02-26 浏览次数:244 类型:单元试卷
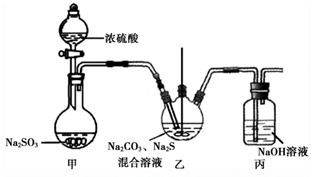
已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:。
③丙中,NaOH溶液吸收的气体可能有。
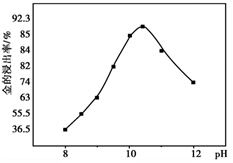
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:i.Cu(NH3)42+
+ Au + 2S2O32− Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH−
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:。
② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因。(写出2点即可)
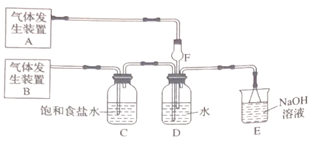

①氯化铁溶液②氯化亚铁溶液③硫氰化钾溶液④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内;再加入(选填一个序号)试剂。发生的现象是 。
若SO2过量,取适量D中溶液滴加至盛有(选填一个序号)试剂的试管内,发生的现象是 。

A中发生反应的化学方程式是。
|
序号 |
试管 |
操作 |
现象 |
|
① |
2 mLB中溶液 |
加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 |
不变蓝 |
|
② |
2 mLB中溶液 |
滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 |
变蓝 |
|
③ |
2 mLH2O |
滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 |
不变蓝 |
实验③的目的是。
|
装置 |
操作 |
现象 |
|
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
溶液迅速变为棕色的原因是。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。

Fe(OH)x(SO4)y中x=(用含V1、V2的代数式表示)。
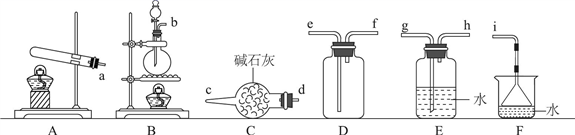
氨气的发生装置可以选择上图中的(填大写字母),反应的化学方程式为。
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。

打开k1 , 缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1 , 恢复室温。试管中可观察到的现象是。发生反应的化学方程式为。

仪器X的名称是,其主要作用有导气、。
铜的测定:取20.00mL测液,经测定, 浓为
。则称取的样品中
mol。

①滴定时,应选用下列哪种物质作为指示剂(填标号)。
A. B.
C.
②重复实验操作三次,消耗 溶液的体积平均为10.00mL。则称取的样品中
mol。


回答下列问题:

已知:反应I、II的化学方程式分别为Si+3HCl=SiHCl3+A,SiHCl3+B=Si+3HCl( 均已配平)。
①A的化学式为。
②反应I、II、III中,有个属于氧化还原反应。
③反应IV中生成的SiH4和NH3两种气体的物质的量之比为。
①分别写出生成D和F的化学方程式:、。
②要将NaOH高温熔化,下列坩埚中可选用的是。
a.普通玻璃坩埚
b.石英玻璃坩埚
c.氧化铝坩埚
d.铁坩埚
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
试题篮