修改时间:2020-08-24 浏览次数:220 类型:一轮复习
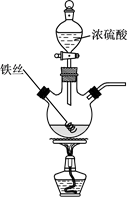
将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。

请回答该实验中的问题。

已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:


仪器X的名称是,其主要作用有导气、。
铜的测定:取20.00mL测液,经测定, 浓为
。则称取的样品中
mol。

①滴定时,应选用下列哪种物质作为指示剂(填标号)。
A. B.
C.
②重复实验操作三次,消耗 溶液的体积平均为10.00mL。则称取的样品中
mol。
试题篮