修改时间:2020-03-31 浏览次数:194 类型:二轮复习
⑴向第一份中加入AgNO3溶液,有沉淀产生;
⑵向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
⑶向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是( )
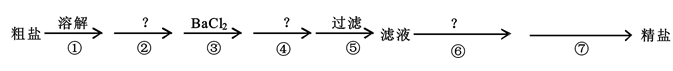
④步所加试剂是。
①它们核外电子总数都相同;
②N 溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y 核内质子总数比K多两个;
④X和N 都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失
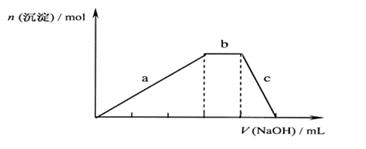
NaOH 溶液,出现了如右图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为
通入氧气在标准状况下的体积 mL
① ;② ;③ ;
④ ;⑤;⑥ .
①根据以上数据,能否推理计算出标准状况下CO2的体积?若能,用代数式表示CO2的体积V(CO2)= .若不能,理由是 .
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示NaOH溶液的浓度c(NaOH)= . 若不能,理由是
试题篮