修改时间:2021-05-20 浏览次数:1032 类型:高考真卷
②NaOH(s)+CO2(g) ![]() NaHCO3(s) ΔH1=−131.5 kJ·mol−1
NaHCO3(s) ΔH1=−131.5 kJ·mol−1
反应2Na2CO3(s) ![]() Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol−1 , 该反应的平衡常数表达式K=。
Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol−1 , 该反应的平衡常数表达式K=。
=。已知Ksp(BaCO3)=2.6×10−9 , Ksp(BaSO4)=1.1×10−10。
18-Ⅰ.
香茅醛( ![]() )可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有( )
)可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有( )
18-Ⅱ.
当醚键两端的烷基不相同时(R1-O-R2 , R1≠R2),通常称其为“混醚”。若用醇脱水的常规方法制备混醚,会生成许多副产物:
R1—OH+ R2—OH ![]() R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
一般用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,某课外研究小组拟合成 ![]() (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:
Ⅰ: ![]()
Ⅱ:① ![]()
② ![]()
③ ![]()
回答下列问题:
1)路线Ⅰ的主要副产物有、。
2)A的结构简式为。
3)B的制备过程中应注意的安全事项是。
4)由A和B生成乙基苄基醚的反应类型为。
5)比较两条合成路线的优缺点:。
6)苯甲醇的同分异构体中含有苯环的还有种。
7)某同学用更为廉价易得的甲苯替代苯甲醇合成乙基苄基醚,请参照路线Ⅱ,写出合成路线。
下列叙述正确的有( )
ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
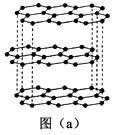
1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为,原子间存在的共价键类型有,碳原子的杂化轨道类型为。
2)SiCl4分子的中心原子的价层电子对数为,分子的立体构型为,属于分子(填“极性”或“非极性”)。
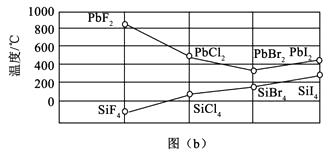
3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性、共价性。(填“增强”“不变”或“减弱”)
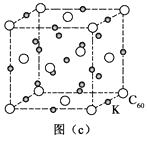
4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为;其晶胞参数为1.4 nm,晶体密度为
g·cm-3。
试题篮