修改时间:2024-07-13 浏览次数:166 类型:高考模拟

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
装置甲玻璃仪器名称为;装置乙中反应的离子方程式为。
某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是(填方案编号)。
|
Ⅰ |
克劳斯法 |
|
| Ⅱ | 铁盐氧化法 | |
| Ⅲ | 光分解法 | |
① 反应Ⅰ的化学方程式是。
② 反应Ⅱ:+ 1 H2S ==Fe2+ + S↓ + (将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:。

过程甲、乙中,氧化剂分别是。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+ , p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+ , (写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:。
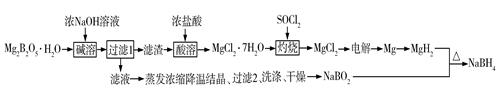
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
①写出正极的电极反应式:。
②若电路中有0.038 mol转移电子时,则溶液pH约为(忽略体积变化,不考虑H2O2电离)。


回答下列问题:
①既能发生银镜反应,又能发生水解反应;②属于芳香族化合物;③苯环上只有2个取代基。
试题篮