题型:实验探究题 题类:常考题 难易度:困难
贵州省贵阳市普通高中2017-2018学年高三上学期化学开学考试试卷

本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(用离子方程式解释)。
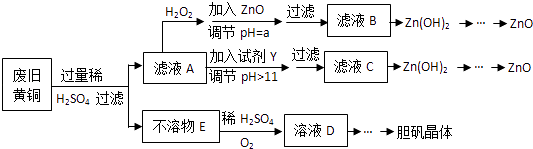
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算).
|
|
Fe3+ |
Fe2+ |
Zn2+ |
|
开始沉淀的pH |
1.1 |
5.8 |
5.9 |
|
沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:

反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
|
操作 |
现象 |
|
a.测溶液pH,并向其中滴加2滴酚酞 |
pH=13,溶液变红,5min后褪色 |
|
b.向其中逐滴加入盐酸 |
溶液逐渐变成黄绿色 |


已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
试题篮