题型:实验探究题 题类:模拟题 难易度:普通
四川省成都市2017-2018学年高考理综-化学三模考试试卷
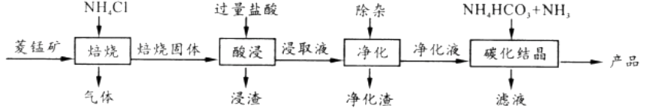
已知:MnCO3+2NH4Cl MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
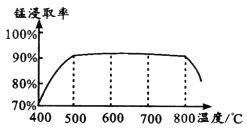
焙烧时适宜温度为;800℃以上锰的浸取率偏低,可能原因是。
②加氨水调pH,生成沉淀主要是;
③加入NH4F,除去Ca2+、Mg2+。
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4 , 发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I- , 滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是。
②假设杂质不参与反应,则产品纯度为。
试题篮