羟胺的电离方程式为: NH
2OH+H
2O

NH
3OH
++OH
-( 25℃时, Kb=9.0×10
-9)。用 0.1 mol·L
-1 盐酸滴定 20 mL 0.1mol·L
-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H
+浓度的负对数与盐酸体积的关系如图所示(已知: lg3=0.5)。下列说法正确的是( )
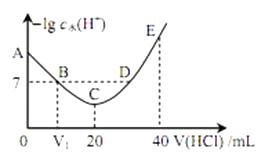
A、图中 V1>10
B、A 点对应溶液的 pH=9.5
C、B, D 两点对应的溶液均为中性
D、E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
