题型:实验探究题 题类:模拟题 难易度:普通
江苏省泰州市2017-2018学年高考化学一模考试试卷
I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
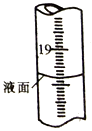
步骤4 向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62- )。
步骤5....
步骤6 数据处理,计算黑灰中BaS含量。
酸性矿井水( 主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/L BaCl2溶液)

| 选项 | 甲 | 乙 | 丙 |
| A | MgCl2 | HNO3 | K2SO4 |
| B | BaCl2 | HNO3 | K2SO4 |
| C | NaNO3 | H2SO4 | Ba(NO3)2 |
| D | BaCl2 | HCl | CaCl2 |
试题篮