题型:综合题 题类:模拟题 难易度:普通
四川省绵阳市2017-2018学年高三理综-化学二模考试试卷
① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= 。
反应温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64 | 50.7 | 42.9 |
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。
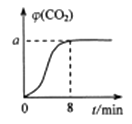
①前 8minCO 的反应速率为;平衡时a=。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2 , 平衡移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是(填标号)。
A.增大Fe2O3用量
B.增大压强
C.降低温度
D.向容器中再充入少量CO
试题篮