题型:综合题 题类:常考题 难易度:普通
高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第一节 化学反应速率 化学反应速率
【实验目的】测定锌与稀硫酸反应的速率
【实验用品】锥形瓶、双孔塞、胶皮管、分液漏斗、直角导管、50mL注射器、铁架台、秒表、锌粒、1 mol/L硫酸、4 mol/L硫酸。
【实验步骤】
①取一套装置(如图所示),加入40 mL 1 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
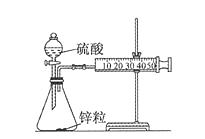
②取另一套装置,加入40 mL4 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
加入试剂 | 反应时间 | 反应速率 |
40 mL 1 mol/L硫酸 | 长 | |
40 mL 4 mol/L硫酸 | 短 |
①锌的颗粒(即表面积)大小;
②40 mL的硫酸要迅速加入;
③装置,且计时要迅速准确;
④气体收集可以用排水量气装置(如图所示)代替。

①。
②。
试剂 实验 | 甲 | 乙 | 丙 | 丁 |
4mol•L﹣1H2SO4/mL | 20 | V1 | V2 | V3 |
饱和CuSO4溶液/mL | 0 | 2.5 | V4 | 10 |
H2O/mL | V5 | V6 | 8 | 10 |
收集气体所需时间/s | t1 | t2 | t3 | t4 |
试题篮