题型:综合题 题类:常考题 难易度:普通
河北省邯郸市2017-2018学年高一上学期化学期中考试试卷
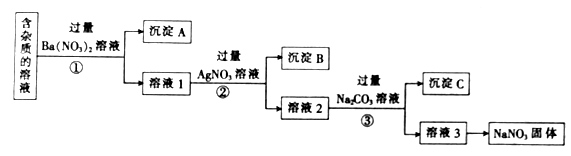
①配制溶液前要先计算,需称取NaNO3固体g。
②某同学转移溶液的操作如图所示,图中仪器的名称是烧杯和,该同学操作中的错误是。
③若用胶头滴管定容时,不小心加水超过了刻度线,则应该采取的处理方法是。
④下列操作中,可能造成所配制溶液的浓度偏低的是(填字母)。
a.没有洗涤烧杯和玻璃棒
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水

已知:
①金属离子开始沉淀和沉淀完全时的pH:
|
|
Fe3+ |
Ni2+ |
Cr3+ |
|
开始沉淀 |
1.5 |
6.7 |
4.0 |
|
沉淀完全 |
3.4 |
9.5 |
6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3⇌[Ni(NH3)6]2+
试题篮