题型:综合题 题类:常考题 难易度:普通
化学平衡的计算g 40
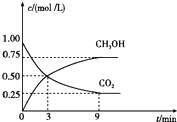
①从3min到9min,v(H2)=mol/(L•min).
②能说明上述反应达到平衡状态的是(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2 , 同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
下列说法正确的是 .
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
试题篮