题型:综合题 题类:常考题 难易度:普通
化学平衡的计算g 40
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol﹣1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol﹣1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=kJ•mol﹣1 .
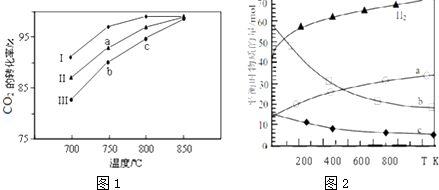
①a点所代表的状态(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是.
①该进行的反应的△S0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举2项)
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
试题篮