题型:综合题 题类:模拟题 难易度:普通
2017年河北省保定市高考化学二模试卷
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJ.mol﹣1) | 414 | 489 | ? | 155 |
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32﹣﹣12e﹣═8CO2+3H2O.写出该燃料电池的正极反应式.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式.
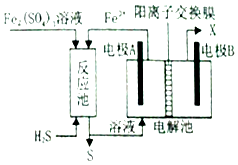
①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为.
②反应池中发生的离子反应方程式为.
试题篮