题型:综合题 题类:模拟题 难易度:普通
2017年北京市西城区高考化学一模试卷
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10mol•L﹣1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10mol•L﹣1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10mol•L﹣1 Fe2(SO4)3溶液,再加入少量0.0005mol•L﹣1 Ag2SO4溶液 | 98.0 |
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是.
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L﹣1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中,证明发生反应 i.
b.取少量Ag2S粉末,加入溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
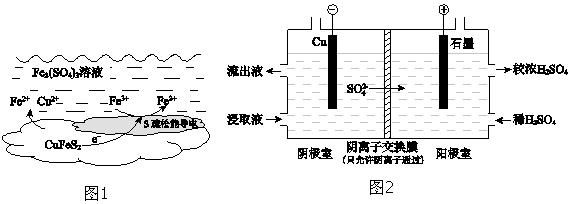
①电解初期,阴极没有铜析出.用电极反应式解释原因是.
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是.
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向待测溶液中先滴加几滴氯水,然后滴加KSCN溶液 | 溶液变红 | 待测溶液中含有Fe2+ |
B | 向KMnO4酸性溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3·H2O能大 量共存 |
D | 向10mL0.1mol·L-1Na2S溶液中滴入2mL0.1 mol·L-1ZnSO4溶液,再加入0.1 mol·L-1CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A | B | C | D |
| | | | |
| 铜的精炼 | 构成铜锌原电池 | 铁上镀银 | 防止Fe被腐蚀 |
选项 | 实验操作及现象 | 实验结论 |
A | 向试管中加入2mL 0.5mol/L的CuCl2溶液,加热,溶液由蓝色变为黄绿色;再置于冷水中,溶液又恢复为蓝色 | 溶液中存在平衡: |
B | 用氯化铝溶液做导电性实验,电流表指针偏转 | 氯化铝属于离子化合物 |
C | 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液中,品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
D | 常温下将铁片和铜片用导线相连插入浓硝酸中,前者明显溶解,后者产生气体 | 铁的还原性比铜强 |
试题篮