题型:综合题 题类:常考题 难易度:困难
广东福建等省2019-2020学年高三下学期化学4月理综试卷(全国I卷)
A. ![]()
B. ![]()
C. ![]()
D. ![]()
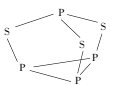
①P4S3分子中硫原子的杂化轨道类型为。
②每个P4S3分子中含有的孤电子对的数目为对。

|
碳酸盐 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
热分解温度/℃ |
402 |
900 |
1172 |
1360 |
|
金属阳离子半径/pm |
66 |
99 |
112 |
135 |

试题篮