题型:实验探究题 题类:常考题 难易度:普通
实验探究物质的组成成分以及含量
吸收的铁元素,反应的化学方程式为.
1)图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是(选填序号).
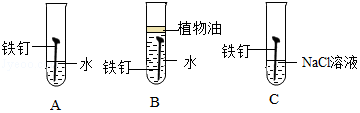
2)铁生锈的主要过程为:Fe Fe(OH)2
Fe(OH)3
Fe2O3•xH2O
次要过程为:Fe FeCO3
写出 Fe→Fe(OH)2反应的化学方程式.
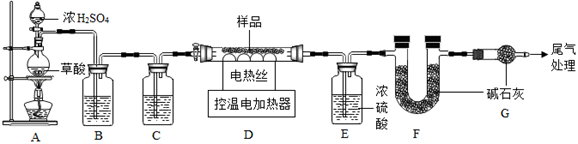
【查阅资料】①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2 . 度高于500℃时铁的氧化物才能被CO还原.
1)装配好实验装置后,首先要.
2)装置A中的反应为:H2C2O4(草酸) CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放(选填序号).
a.浓硫酸 b.澄清的石灰水 c.足量氢氧化钠浓溶液
3)现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重1.1g.则样品中FeCO3的质量m(FeCO3)=g,x=.
4)若缺少G装置,测得的m(FeCO3)(选填“偏大”、“偏小”、“不变”,下同),x的值会.
1)写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式.
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO 2Fe3O4+CO2
阶段2:Fe3O4+CO 3FeO+CO2
阶段3:FeO+CO Fe+CO2
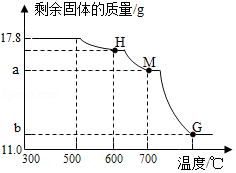
2)将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼铁过程的探究.加热时测定D中剩余固体质量随温度变化的曲线如图所示.图中M点对应的a=,b=.
试题篮