题型:实验探究题 题类:常考题 难易度:普通
2015-2016学年四川省宜宾市普通高中高二上学期期末化学试卷
组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
C(KI) | V | C(H2SO4) | V | ||||
1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
3 | 298K | 1mol/L | 5mL | ① | 5mL | 3滴 | |
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
实验方案 | 预期实验现象与结论 |
取少量于试管中,滴入几滴淀粉 溶液,然后逐滴加入,观察现象 | 若,则假设二正确 |
(限选试剂:1mol/L盐酸、1mol/L KOH溶液、碘水、淀粉溶液)
序号 | 实验内容 | 实验目的 |
A | 用石墨电极电解Mg(NO3)2、Cu(NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
C | 室温下,用pH试纸测定浓度为0.1mol•L﹣1 NaClO溶液和0.1mol•L﹣1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
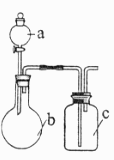
实验目的 | a中试剂 | b中试剂 | c中试剂 | |
A | 比较 | 醋酸溶液 | 碳酸钠 | 硅酸钠溶液 |
B | 比较 | 浓盐酸 | 高锰酸钾 | 碘化钾溶液 |
C | 证明苯和液溴发生取代反应 | 苯和液溴 | 铁粉 | 硝酸银溶液 |
D | 证明 | 饱和食盐水 | 电石 | 酸性高锰酸钾溶液 |
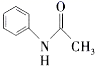 )在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过本胺(
)在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过本胺( 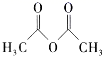 )反应制得。
)反应制得。 已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
| 温度 | 20 | 25 | 50 | 80 | 100 |
| 溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)乙酸酐放入三口烧瓶c中,在恒压滴液漏斗a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用( )洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。

Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,( ),称量产品为3.28g。
回答下列问题:
试题篮