题型:综合题 题类:模拟题 难易度:普通
2016年新疆乌鲁木齐市八一中学高考化学二模试卷

已知各种金属离子完全沉淀的pH如表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
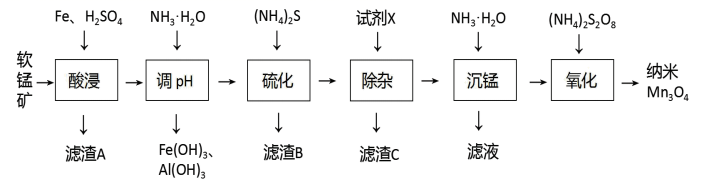
I.难溶物的Ksp如表:
| 物质 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Zn(OH)2 | ZnS | MnS | CaF2 |
| Ksp | 4.0×10-38 | 4.5×10-33 | 1.9×10-13 | 2.0×10-15 | 1.6×10-24 | 2.5×10-13 | 4.0×10-11 |
II.Mn(OH)2+xNH3=[Mn(NH3)x]2++2OH-
回答下列问题:
试题篮