题型:综合题 题类:真题 难易度:普通
2016年高考理综真题试卷(化学部分)(北京卷)
用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.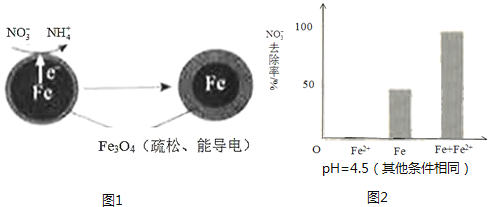
①作负极的物质是.
②正极的电极反应式是.
将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因:.
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因:.

已知:①常温下,部分金属离子(Mn+)形成氢氧化物沉淀的pH范围如下:
Mn+ | Fe2+ | Al3+ | Mg2+ | Ca2+ | Co2+ |
开始沉淀 | 6.3 | 3.8 | 9.6 | 10.6 | 6.6 |
完全沉淀c(Mn+)≤10-6 | 8.3 | 5.4 | 12.0 | 12.6 | 9.1 |
②Ksp[Mg(OH)2]=10-10
回答下列问题:
试题篮