题型:填空题 题类:常考题 难易度:普通
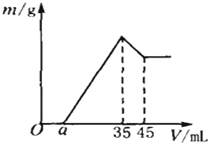
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
(1)原溶液中c(H2SO4)= mol/L
(2)若a=2.3mL,计算各组分的质量:
m(Al2O3)= g;m(Fe2O3)= g;
(3)计算a值的取值范围: <a< .
“铝热反应”的化学方程式为:2Al+Fe2O3 Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据分别如下:
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据分别如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣﹣ |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是:{#blank#}1{#/blank#}
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是{#blank#}2{#/blank#} ,当观察到{#blank#}3{#/blank#} 现象时,说明熔融物中含有金属铝.
(3)实验室溶解该熔融物,最好选用下列试剂中的{#blank#}4{#/blank#} (选填字母序号).
a.浓硫酸 b.稀硫酸 c.稀硝酸 d.氢氧化钠溶液.
试题篮