题型:填空题 题类:常考题 难易度:普通
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景.
(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为﹣285.5kJ/mol、﹣283kJ/mol和﹣1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2 , 将悬浮物带到水面,利于除去.实验室以二甲醚燃料电池模拟该方法设计的装置如图所示:
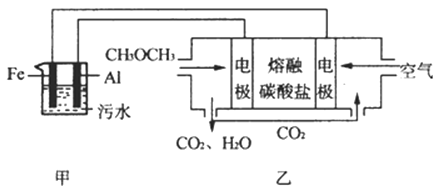
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极.写出该燃料电池的正极电极反应式 下列物质可用做电池熔融碳酸盐的是
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式:
③已知常温下Kap[Fe(OH)3]=4.0×10﹣38 , 电解一段时间后,甲装置中c(Fe3+)=
④已知:H2S的电离平衡常数:K1=9.1×10﹣8、K2=1.1×10﹣12;H2CO3的电离平衡常数:K1=4.31×10﹣7、K2=5.61×10﹣11 . 测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各项正确的是
A.发生反应的离子方程式为:CO2+S2﹣+H2O═CO32﹣+H2S
B.发生反应的离子方程式为:CO2+S2﹣+H2O═HCO3﹣+HS﹣
C.c(Na+)=2[c(H2S)+c(HS﹣)+c(S2﹣)]
D.c(Na+)+c(H+)=2c(CO32﹣)+2c(S2﹣)+c(OH﹣)
E.c(Na+)>c(HCO3﹣)>c(HS﹣)>c(OH﹣)
试题篮