题型:综合题 题类:常考题 难易度:普通
反应1:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)=2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)=2Al(l)+AlCl3(g);ΔH3
试比较a、b的大小,并说明理由:a1b,理由是2。

①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1molAlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。1
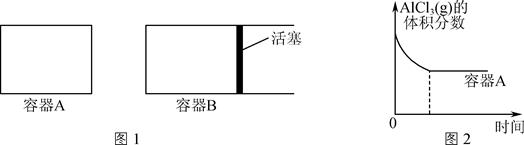
②1100℃时,向2L密闭容器中通入3molAlCl(g),发生反应:3AlCl(g) 2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=2。
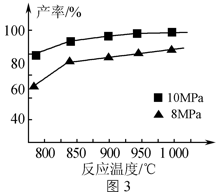
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是3。研究表明,当温度达到2500℃以上时,图中曲线重合,试分析可能原因4。





| 温度(℃) | 15 | 20 | 25 | 30 | 35 |
| 平衡时气体总浓度(×10-3mol·L-1) | 2.40 | 3.40 | 4.80 | 6.80 | 9.40 |
下列说法正确的是( )
试题篮