25℃,用浓度为0.1000mol·L
-1的NaOH溶液滴定20.00mL浓度均为0.1000mol·L
-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是( )
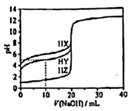
A、HZ为强酸,HY、HX均为弱酸,且相同条件下Ka(HX)<Ka(HY)
B、加入10.00 mLNaOH溶液时,三种溶液中水的电离程度大小为:HX<HY<HZ
C、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+)
D、HY溶液中加入20.00 mLNaOH溶液,溶液中存在:c(OH-)=c(HY)+c(H+)
