题型:综合题 题类:常考题 难易度:普通
陕西省西安中学2018-2019学年高三上学期化学期中考试试卷
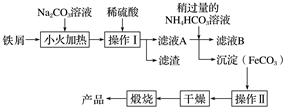
①操作Ⅰ的名称是;操作Ⅱ为洗涤,洗涤操作的具体方法为。
②滤液A中加入稍过量的NH4HCO3溶液,生成沉淀的同时有一种气体(能使澄清石灰水变浑浊)产生,写出其化学方程式: 。
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是(填序号)。
a.硝酸 b.盐酸 c.硫酸
②上述产品中Fe2O3的质量分数为。
选项 | a | b | c |
A | SiO2 | Na2SiO3 | H2SiO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Fe | Fe(OH)3 | Fe2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
试题篮