题型:综合题 题类:常考题 难易度:普通
江苏省盐城市2018-2019学年高二下学期化学期末考试试卷
①已知下列热化学方程式:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g)
CH4(g)+2H2O(g) △H 2=-165kJ/mol,
则反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的△H=kJ/mol。
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为。

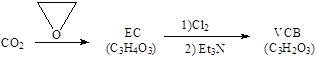
VCB的结构简式为。
(I)乙烷直接热解脱氢:C2H6(g) C2H4(g)+H2(g) △H1
(Ⅱ)CO2氧化乙烷脱氢:C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g) △H2
①反应(I)的△H1= kJ/mol(填数值,相关键能数据如下表)。
| 化学键 | C-C | C=C | C-H | H-H |
| 键能/kJ·mol-1 | 347.7 | 615 | 413.4 | 436.0 |
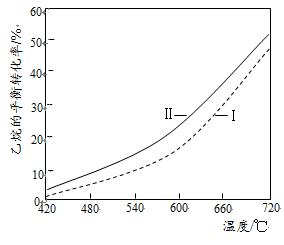
②反应(Ⅱ)乙烷平衡转化率比反应(I)的大,其原因是(从平衡移动角度说明)。
③有学者研究纳米Cr2O3催化CO2氧化乙烷脱氢,通过XPS测定催化剂表面仅存在Cr6+和Cr3+ , 从而说明催化反应历程为:C2H6(g)→C2H4(g)+H2(g),和(用方程式表示,不必注明反应条件)。
④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应:C2H6(g) C2H4(g)+H2(g)。温度及投料方式(如下表所示),测得反应的相关数据如下:
| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 600 | 600 | 500 |
| 反应物投入量 | 1molC2H6 | 2molC2H4+2molH2 | 1molC2H6 |
| 平衡时v正(C2H4)/ mol/(L·s) | v1 | v2 | v3 |
| 平衡时c(C2H4)/ mol/L | c1 | c2 | c3 |
| 平衡常数K | K1 | K2 | K3 |
下列说法正确的是(填标号)。
A.K1=K2 , v1<v2
B.K1<K3 , v1< v3
C.v2>v3 , c2>2c3
D.c2+c3<3c1
试题篮