题型:综合题 题类:常考题 难易度:普通
广西南宁市第三中学2017-2018学年高二下学期化学(理)期末考试试卷
①下图能正确表示该反应中能量变化的是;
A、 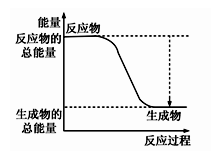
B、 
②根据下表数据,计算生成1molNH3时该反应放出的热量为kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=,反应开始与平衡时气体的物质的量之比为;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 , 请用p0、p来表示达到平衡时H2的转化率为。
④在③反应条件下,能够判断该反应已经达到化学平衡状态的是。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成nmolN2的同时生成2nmolNH3
D.v(N2)=2v(NH3)

①装置甲中SO42-向极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为mol。
试题篮