修改时间:2024-07-12 浏览次数:633 类型:期末考试

①下列对该过程的分析正确的是(填写序号)
A、反应前后原子的种类、数目不发生改变 B、乙烯的化学式为C2H4
C、参加反应的二氧化碳和氢气的分子个数比为1:4 D、该反应属于复分解反应
②请写出该反应的化学方程式:.
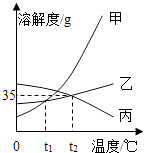
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 氯化钾 | 27.6 | 34.0 | 40.0 | 45.5 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110.0 | |
A、溶质的质量 B、溶剂的质量 C、溶液的质量 D、溶质质量分数.

请你完成下列问题:
①操作Ⅱ中,除去氯化镁发生反应的化学方程式为;
②操作Ⅱ中,加入过量的碳酸钠溶液的目的是.
| ①同学们做了如图所示A试管和B试管的对比实验,发现B中固体可溶,A中几乎不溶,该对比实验说明了影响物质溶解性的因素是; ②同学们又补充了C试管所示实验,他们想探究的影响因素是. |
| ①实验中需要控制的变量除了氯化铁和硫酸铜的质量、过氧化氢溶液的体积,还有、(填两条) ②可通过观察来定性比较两者的催化效果. |
| 木炭在氧气里燃烧比在空气里燃烧更剧烈,说明了影响木炭燃烧剧烈程度的因素是. |
| ①分别震荡三个软质塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为. ②对比A瓶与瓶的实验现象,可证明二氧化碳能与氢氧化钠溶液发生反应. |
请分析实验过程,回答下列问题:

【提出问题】无色滤液中呈碱性的物质是什么?
【作出猜想】
猜想Ⅰ:碳酸钠
猜想Ⅱ:氢氧化钠
猜想Ⅲ:碳酸钠和氢氧化钠
【设计实验】
实验操作 | 实验现象 |
取无色滤液少许于试管中,滴加足量的X溶液 | 观察到现象A |
【收集证据】
①若现象A是有气泡产生,则X溶液为,则猜想不成立.
②若现象A是有白色沉淀生成,X溶液为;取反应后的上层清夜,测定其pH,当pH7(选填“>”或“<”或“=”),则猜想Ⅲ成立.
【进行实验】兴趣小组的同学们依据设计的实验进行探究,得出白色粉末的组成.
【实验反思】实验中需滴加足量X溶液的目的是
试题篮