修改时间:2024-07-13 浏览次数:167 类型:高考模拟

氧原子核外有种运动状态不同的电子;碘原子最外层电子的排布式为;K2CO3固体中含有的化学键有。
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
该反应的氧化产物为,若反应过程中有4 mol HCl参与反应,则电子转移的数目为。
向浓缩的海水中通入Cl2 , 将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是。
在0~5min内,H2的平均反应速率v(H2)= 。
A.一定向正反应方向移动 B.平衡移动时,逆反应速率始终增大
C.一定向逆反应方向移动 D.平衡移动时,正反应速率始终减小
主反应:
副反应:
将反应物混合气体按进料比n(CO):n(H2)=1:3通入反应装置中,选择合适的催化剂,发生上述反应。
不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2的平衡转化率随温度的升高而增大的原因是。实际生产中,保持压强不变,相对反应时间内不同温度下CH3OH的产率如图②所示,由图可知,523K时CH3OH的产率最大,可能的原因是。

合成氨工厂常用碳酸钾溶液吸收混合气中的CO2 , 从而实现CO2的减排。
a. c(K+)+c(H+)=c(CO )+c(HCO
)+c(OH-)
b. 3c(K+)=4c(CO )+4c(HCO
)+4c(H2CO3)
c. c(K+)>c(OH-)>c(HCO )>c(CO
)>c(H+)
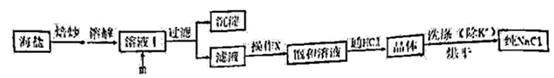
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳

①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是(填编号),相比分液漏斗,选用仪器a的优点是。
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是。
| 操作 | 目的/结论 | |
| ① | 称取样品 | 目的:。 |
| ② | 过滤洗涤,干燥后称得沉淀为m2g | 结论:样品中SO |
试题篮