修改时间:2024-07-13 浏览次数:354 类型:月考试卷
②H2(g)+1/2O2(g) = H2O(l) ΔH2=-285.8 kJ·mol-1。
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O—H | 465 |
O | 498 |
下列说法错误的是( )
MnO4-+5e-+8H+→Mn2++4H2O;MnO4-+3e-+2H2O→MnO2+4OH-;MnO4-+e-→MnO42-。由此可知,高锰酸根离子(MnO4-)反应后的产物与有关。
实验1:探究Na2CS3的性质
|
步骤 |
操作及现象 |
|
① |
取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
|
② |
向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
|
③ |
向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
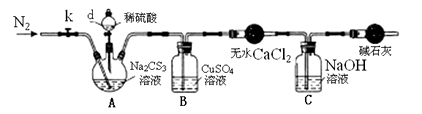
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
盛放无水CaCl2的仪器的名称是。
N2(g)+3H2(g) 2NH3(g)。
①合成氨的反应中的能量变化如右图所示。该反应是反应(填“吸热”或“放热”),

②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ⇌2NH3(g) , 5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)= ;氢气达到平衡时的转化率是: (保留小数点后一位);
试题篮