修改时间:2018-12-12 浏览次数:181 类型:单元试卷
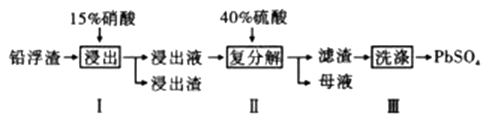
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
A.稀硫酸
B.稀盐酸
C.硝酸铅溶液
D.酒精
CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是(填“A” 或“B ”)。
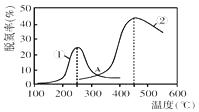
②按一定体积比加入CH4和CO2 , 在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是。

电池的负极反应式:。
电池的正极反应式:6O2+6e−=6O2−
6CO2+6O2−=3C2O42−
反应过程中O2的作用是。
该电池的总反应式:。
N2(g)+ O2(g)= 2NO(g) ΔH= b kJ·mol -1
H2O(l)= H2O(g) ΔH= c kJ·mol -1
则C2H4(g)+6NO(g) 3N2(g)+2CO2(g)+2H2O(l) 的反应热ΔH=。
以下说法正确的是 。
在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如下图所示。
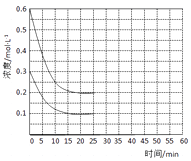
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2 , 则此时v(正)v(逆)(填>、<或=)。判断的理由是。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和 1molCO2 , 在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。
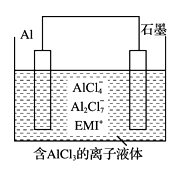
该电池放电时的负极反应方程式为
试题篮