修改时间:2024-07-13 浏览次数:296 类型:期中考试
选项 | 实验操作 | 现象 | 结论 |
A | 将Na2O2粉末用脱脂棉包裹,向其中吹入CO2 | 粉末变白,脱脂棉剧烈燃烧 | Na2O2与CO2的反应是放热反应 |
B | 向Fe(NO3)3溶液中通入SO2 , 再 滴加BaCl2溶液 | 产生白色沉淀 | 氧化性: NO3->Fe3+ |
C | 向2支盛有5 mL相同浓度稀氨水的试管中分别加入5滴0.1mol/L相同浓度的CuCl2溶液 和CaCl2溶液 | 一支试管中产生蓝色沉淀,另一支无明显现象 | Ksp[Cu(OH)2]< Ksp[Ca(OH)2] |
D | |将浓硫酸滴在棉花上 | 棉花变黑 | 浓硫酸有脱水性 |

已知:①NO+NO2+2OH-=2NO2-+H2O;
②气体液化的温度:NO2:21℃,NO:152℃。
②A中反应的化学反应方程式为。
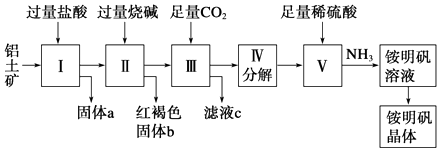
请回答下列问题:
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的最高价氧化物对应水化物的酸性
C.比较只有这两种元素所形成的简单化合物中元素的化合价
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3混合溶液中,生成两种碱,写出该反应的总离子方程式。
②上述反应得到的两种碱在一定条件下继续作用得到Fe3O4 , 写出该反应的化学方程式。
由此写出NO和CO反应的热化学反应方程式。
0 min | 5 min | 10 min | 15 min | 20 min | ||
c(NO2)/ mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 | |
C(N2)/ mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5〜10min,用N2的浓度变化表示的反应速率为。
②以下表述能说明该反应己达到平衡状态的是。
A.气体颜色不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡 (填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= (保留两位有效数字)。
①写出该电池的负极反应式;
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=。(忽略溶液的体积变化,已知1g2=0.3,lg5=0.7)
试题篮